ドラッグ・ラグとは、世界ではすでにその使用が承認されている医薬品が、日本では数年後に承認されることによって、必要とする患者さんへのアクセスが妨げられていることを言います。
PanCAN Japanを立ち上げた2006年ごろ、膵臓がんの治療薬はFDA承認後、日本で使用できるまで5~6年かかっていました。余命が短い膵臓がんにとって、この期間はとても待てるものではありません。
様々な患者団体が要望を届け、その後、国際共同治験を推進するなどして一度はドラッグ・ラグ解消の方向に向かいました。
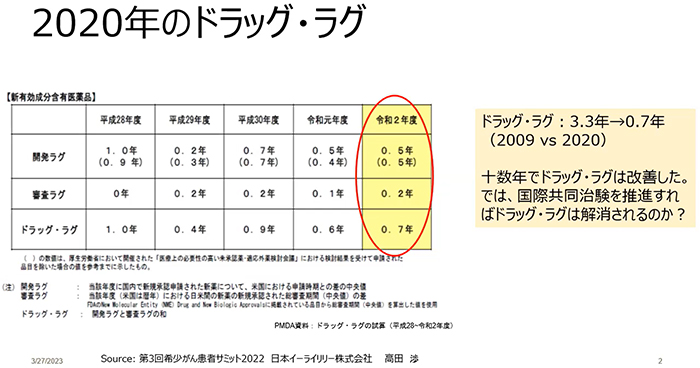
しかし、大手の製薬企業が主体となっていた国際共同治験での役割が減り、新薬の開発がベンチャー企業主体に移行したことなどを背景に、近年では日本で新薬の開発に取り組む製薬企業そのものが非常に少なくなってしまいました。
特に、希少・難治性がんの領域においては、その困難さから、日本の企業は全く参加できておらず、私が罹患した神経内分泌腫瘍(下図右赤枠)は、33種類の開発品目に日本で開発中の薬剤はありません。新薬ができても日本の患者さんが使えない状況になること、つまりドラッグ・ロスの可能性があるということです。
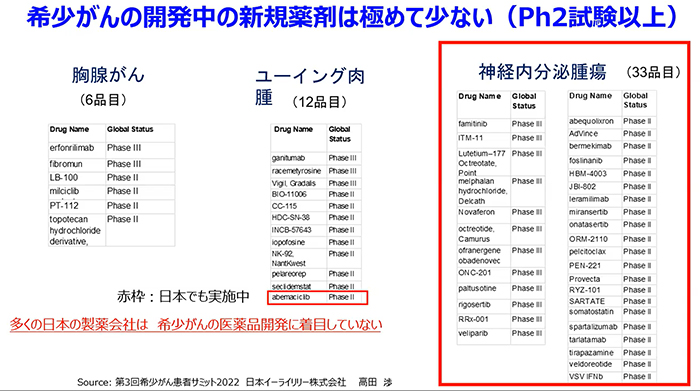
希少・難治性がんの領域のドラッグ・ラグ再燃の解消には、薬事制度上の改革と、関係各位(産・官・学・患・国民)が一つになって制度を改善していく支援体制が必要であると考えます。具体的に、薬事制度改革に関しては、国際共同治験にもとづく審査・承認制度の緩和、症例数が少ない場合の薬事承認に必要なデータの明確化、疾患・遺伝子変異毎の国内患者数を海外にオープンにするなどが挙げられます。
なかでも、新薬、特に希少がんに関して重要な役割を果たしているのがオーファン指定制度です。日米欧それぞれしくみを構築しており、オーファンドラッグへのアクセス迅速化を目的としています。
しかし、下図のように、アメリカで指定された薬の約7%しか日本ではオーファン指定を受けていません。日本ではフェーズ3の承認申請直前でないとオーファン指定を受けられないという実態があり、オーファン指定を受けることが投資家への説得材料になるベンチャー企業にとっては特に、早期から日本で研究開発を行う意欲が削がれるのではと懸念しています。
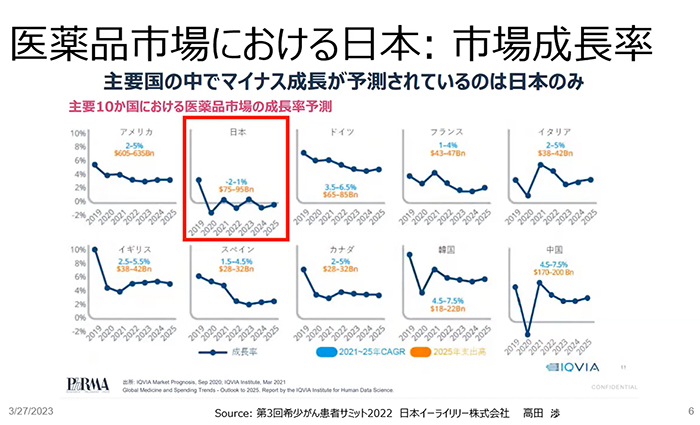
各国の医薬品市場成長率を見ると、日本市場のみマイナス成長が予想されています。このままだと世界の製薬企業、特にベンチャー企業は日本への投資意欲が湧くとは思えません。前向きな投資判断が出来る予見性のある薬価制度の構築に向けても改革が必要だと思います。

ドラッグ・ラグ、ドラッグ・ロスを解消し、医薬品へのアクセスが迅速にできるよう、新薬を心から必要としている患者・市民の声を取り入れながら制度改革や法整備を進めてほしいと切に願っています。
2023年4月25日掲載
