ドラッグラグ問題が続く膵臓がん
日本では、1981年からがんが死亡原因の第1位になっており、がん大国ともいわれています。そうした現状を憂い、2006年5月に故・山本孝史議員が参議院本会議において自身ががんに罹患していることを公表し、がん対策基本法の早期成立を訴えました。それを受けて同年6月、衆議院本会議において全会一致で同法の施行が可決・成立し、我が国のがん医療の環境整備がスタートしました。その後、全がんの5年生存率は徐々に改善し、現在は約70%に届くところまできました。しかも男性の前立腺がんや女性の乳がんの5年生存率は90%以上になってきました。しかし、膵臓がんの5年生存率は過去40年間一桁台に低迷したままとなっています。がんのなかで一番アンメットニーズの高いのが膵臓がんです。
この非常に厳しい膵臓がんの患者が受ける医療をめぐる課題の1つにドラッグラグ問題があります。ドラッグラグとは、世界で標準的に使われている医薬品が日本では数年遅れで承認されるため、必要としている患者さんを救うことができないという問題です。このドラッグラグは、近年のPMDAの努力によって膵臓がんを含む様々ながん領域でかなり解消されてきていますが、解消されていない部分がまだたくさん残っています。
新薬であれば製薬企業も資金投下して承認申請に向けた努力をしますが、一旦医薬品のパテントが切れ、ジェネリック医薬品がでてくると、その薬を使った併用療法が欧米で承認されたとしても、日本での承認は難しくなります。その例が、膵神経内分泌腫瘍の患者が期待する「カペシタビンとテモゾロミド(CAPTEM)」の併用療法です。米国で使用されている「シスプラチン」などもパテントが切れており、ジェネリック医薬品も多数の製薬企業から販売されていることから、日本で適応拡大するための承認が難しい状況です。また、ゲノム医療ではバイオマーカーベースで治療薬が投与されますが、米国では適応外薬でも使用できることから多数の新薬を使用した治験が進められています。しかし、日本ではそのような膵臓がんでは未承認である適応外薬を使用した治験は、製薬企業の資金と医薬品提供がないと難しい現状があります。
さらにドラッグラグ問題の解決策として推奨されてきたのが、国際共同治験への参加です。国際共同治験に日本が参加し、日本人の患者さんが登録され、データを取ることが承認への近道であることが以前から指摘されています。これは日本に支社のある欧米の大手製薬企業が開発している医薬品であれば可能性はありますが、そうでなければ可能性は著しく低くなります。例えば、米国では、イノベーティブな抗がん剤はベンチャー系の企業が開発し、完成されたものを大手の製薬企業が買収するというケースが少なくありません。このベンチャー系企業が開発し、米国で承認された医薬品を日本に導入することはそれほど容易ではありません。なぜなら、日本にはそうしたベンチャー系企業の日本支社が基本的に無いからです。そのため、ベンチャー系企業の開発する抗がん剤の国際共同治験に、日本が参加できる機会はほとんどありません。それが、医薬品のドラッグラグ問題がなかなか解消されない大きな理由といわれています。
ゲノム医療とバイオマーカーベースの医薬品
私どもNPO法人パンキャンジャパンの本部は米国・ロサンゼルスにあり、そこで集めた寄付金の大部分をゲノム医療の研究に投下しています。これまでに2000人以上の膵臓がん患者さんの検体を集めて遺伝子解析し、その結果を治療法の開発に役立てています。2017年、膵臓がん領域にとってはうれしいことがありました。膵臓がんに免疫療法は効かないといわれていたのですが、米国FDAが特定の遺伝子的特徴(dMMRまたはMSI-H)を有する患者に対し、免疫チェックポイント阻害剤ペムブロリズマブを承認したことです。この治療薬は、バイオマーカーに基づいて承認されたFDA初のケースとなりました。難治がんである膵臓がんにも初めて免疫療法が承認されたのです。
これはバスケットトライアル(同じ遺伝子変異をもつ多様ながん種の患者に対して、ある医薬品を試験すること)の中で承認されたため、パンキャンジャパンでは、すぐに厚労省の医薬食品局に出向き、今後海外ではバスケットトライアルによる臓器横断型の抗がん剤の承認が増えると思われるので、ぜひそれに迅速対応できる体制を作ってほしいとお願いしました。その結果、日本でも2018年12月に、ペムブロリズマブが膵臓がんの治療薬として承認されました。さらにラロトレクチニブ(Larotrectinib)というNTRK融合遺伝子阻害剤も、FDAが2018年11月に承認しましたので、この新薬の早期承認を厚生労働省にお願いしました。さらに翌年の2019年12月30日にFDAは、BRCA遺伝子変異のある患者に投与されてきたオラパリブを膵臓がんで承認しました。そこでパンキャンジャパンでは、2020年1月31日にオラパリブの早期承認を求める要望書を厚生労働省医薬審査課に提出しました。
ゲノム医療と創薬イノベーションに期待
Actionable(アクショナブル)な遺伝子変異という言葉があります。これは開発中の薬剤を含む、治療効果が期待できる可能性のある薬剤が存在する標的遺伝子のことです。中でも、すでに米国FDAでも承認された医薬品がある遺伝子変異はHighly Actionableと呼ばれます。2019年の米国臨床腫瘍学会消化器癌シンポジウム2019(GI-ASCO2019)では、Actionableな遺伝子変異をもち、それにマッチする治療を受けられた患者さんと、Actionableな遺伝子変異はあってもそれにマッチする治療を受けられなかった患者さんとでは、治療成績に大きな差があることが発表されました。また、BRAF、ERBB2、ALK、NTRK、BRCA等、ほかのがん種でみられる変異が膵臓がんの患者さんにもみられることが明らかにされました。
図 Actionable Mutation with Matched Therapy 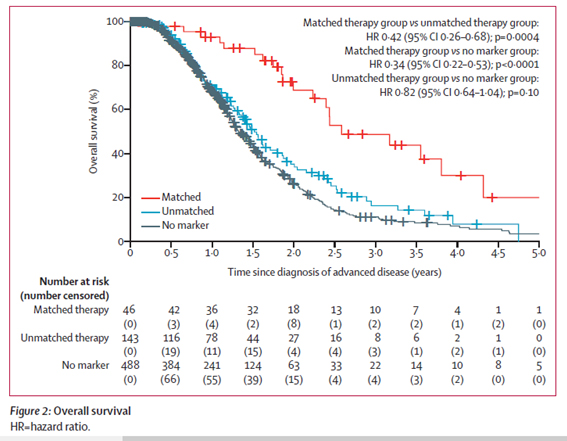
そのため、今後の膵臓がんの化学療法は、がん遺伝子パネル検査を受け、遺伝子変異の違いに基づいて患者さんがグループ分けされ、それぞれにマッチした治療薬が投与される時代になると思われます。それより、バイオマーカーベースで患者さんのバスケットトライアル等の治験への参加登録が進み、膵臓がんに対する創薬も加速される時代がくることが期待されます。イノベーションこそががん患者さんを救う鍵ですので、ぜひ関係者には、膵臓がん研究を促進していただき、Actionableな遺伝子変異とそれにマッチした治療薬の開発を含む「創薬イノベーション」を積極的に進めていただくことを切にお願いいたします。
2020年9月9日掲載
